
MEDICAL 10 - APRILE 2016
XII
Medical
do all’interno della cartella medica del paziente. L’in-
dustria della sanità sta sfruttando le potenzialità delle
nuove tecnologie come ad esempio l’Internet of Things,
il cloud computing e la moderna infrastruttura di rete.
Tutti questi sviluppi stanno rendendo possibile monito-
rare la salute dei pazienti dimessi dalle strutture sanitarie
e di registrare da remoto i loro parametri di salute, oltre
ad essere in grado di reagire in tempo reale alle situa-
zioni di emergenza. Esiste quindi un mercato in piena
espansione relativo ai sistemi di monitoraggio in tempo
reale della salute dei pazienti
La sfida delle normative
A fronte di questa crescita del mercato e della spinta ver-
so sistemi medicali più intelligenti, connessi e integrati, i
produttori si trovano di fronte alla necessità di assicurare
la conformità delle proprie apparecchiature a normative
sempre più stringenti in materia di sicurezza e di affida-
bilità, emesse da un numero crescente di enti normativi
in tutto il mondo.
Un ambiente normativo in evoluzione è spesso citato
come la più grande sfida in assoluto che i produttori di
apparecchi medicali si trovano a dover affrontare. Le
aziende non possono vendere legalmente i propri pro-
dotti fino a quando questi non superino linee guida e
una serie di collaudi abbastanza severi. Il guasto di un
apparecchio medicale può portare a cause legali per
responsabilità mediche. Il numero di normative dipen-
de in larga misura dalla tipologia di apparecchiatura
che un’azienda vuole immettere sul mercato e varia di
conseguenza. Apparecchi meno critici che non sono a
contatto con il corpo del paziente richiedono un ciclo
di approvazioni di conformità che dura circa sei mesi,
mentre gli apparecchi che svolgono funzioni più critiche
e che sono a contatto con il corpo del paziente richiedo-
no cicli di approvazione di circa due anni prima del loro
rilascio sul mercato. Anche nei mercati più consolidati,
come quello dei sistemi per il monitoraggio dei pazienti
o dei sistemi a ultrasuoni, sono richiesti un ciclo di ap-
provazione da parte dell’autorità competenti che dura
fino a un anno e mezzo, a causa della mole di documen-
tazione e di test richiesta. Le società devono creare un
archivio di documentazione tecnica a supporto del pro-
prio prodotto, sottomettere la documentazione all’orga-
nismo competente il quale, al termine di un lungo ciclo
di revisione, approva o respinge il prodotto.
Gli enti regolatori in tutto il mondo esaminano sia l’har-
dware, sia il software, con un particolare occhio di ri-
guardo per quest’ultimo, dato che si ritiene che è più
probabile che errori software portino con molta proba-
bilità il sistema verso uno stato di funzionamento non
conosciuto. Molti dispositivi medicali che devono essere
introdotti sul mercato fanno ricorso a processori em-
bedded. Essi potrebbero non necessitare di una grande
potenza di calcolo, bensì richiedere una certa capacità
di elaborazione embedded e quindi di software. Il pro-
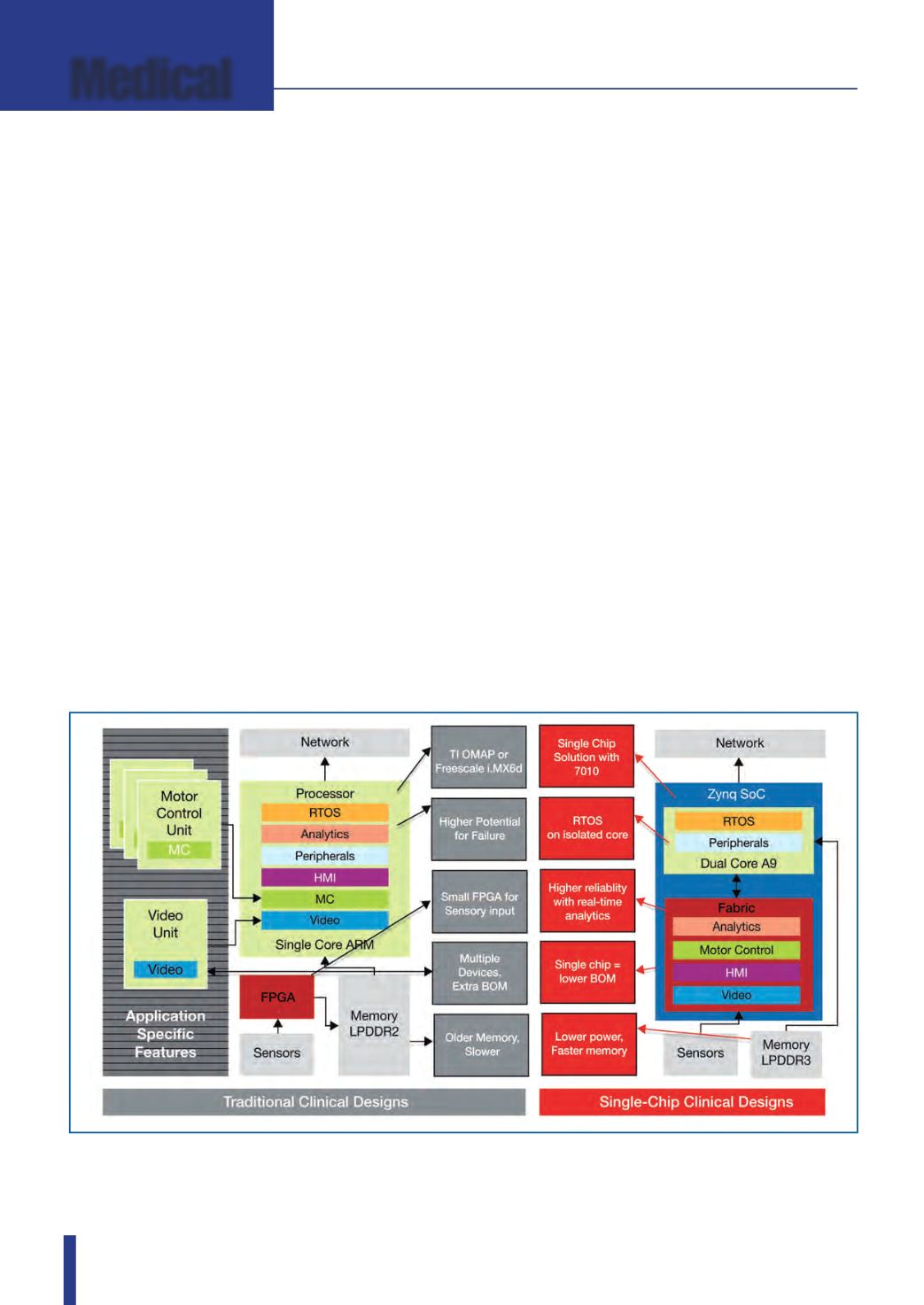
Fig. 1 – Le piattaforme SoC Zynq SoC consentono alle società che sviluppano apparecchiature medicali di creare e
di introdurre sul mercato sistemi innovativi e ottimizzati


















